Nemon
Diskussionsleiter

Profil anzeigen
Private Nachricht
Link kopieren
Lesezeichen setzen

dabei seit 2017Unterstützer
Profil anzeigen
Private Nachricht
Link kopieren
Lesezeichen setzen
Wissenschaftlichkeit und Evidenz in der Medizin: Statine als Exempel
03.06.2025 um 18:19Hier geht es um das, was der Titel schon sagt:
Statine als Exempel für Probleme von Wissenschaftlichkeit und Evidenz in der Medizin.
Dies ist nur ein Archiv, die Diskussionen zu den Themen sollen in geeigneten Threads im Forum stattfinden.
Dies ist keine medizinische Beratung! Persönliche Entscheidungen zur Behandlung und Medikamenteneinnahme müssen unter ärztlicher Beratung stattfinden. Dies findet hier im Forum nicht statt.
Wichtiger Hinweis: Dies ist zum gegenwärtigen Zeitpunkt noch eine Vorabversion zu einer These in der noch nicht alles final ausformuliert und mehrfach gegengeprüft und formatiert ist. Dies geschieht jetzt sukzessive. Alle Links zu Quellen finden sich gesammelt im Literaturverzeichnis am Ende. Ein großes Problem ist, dass man nicht genug in die Tiefe gehen kann, ohne eine vollwertige Studie zu erarbeiten. Und das würde hier ja weit über das Machbare hinausgehen. Zu allem gibt es, wenn man es prüft, ein Wenn und Aber. Das ist nicht mehr darstellbar, dabei geht der Faden der kompakten Zusammenfassung verloren. eigentlich kann es nur darum gehen, eine These einigermaßen solide in den Raum zu stellen. Dafür ist das Thema leider ein problematisches Feld. Am Ende kann die These doch wieder als gerechtfertigt dastehen, obwohl sie zwischenzeitlich zu kippen schien. Auch kommt es in vielen Punkten auf die exakte Fragestellung an: Für wen genau ist in welcher Situation genau welche Intervention indiziert etc. Hier steht Promärprävention als Motto drüber, das kann aber auch schnell aus den Augen verloren werden und wir vermischen es im Eifer des Gefechtes mit diversen klinischen Szenarios. Die Ausarbeitung steht also noch unter starken Vorbehalten.
Statine in der Primärprävention: Schwache Evidenz aber starke Empfehlungen
Statine gelten als Goldstandard der Herzinfarkt-Prävention. Millionen Menschen nehmen diese verschreibungspflichtigen Cholesterinsenker täglich ein, auf ärztliche Empfehlung und gestützt auf internationale Leitlinien. Doch was passiert, wenn man die zugrundeliegenden Studien genauer betrachtet? Wenn man absolute statt relative Risiken analysiert? Und wenn man fragt, warum die spektakulären Ergebnisse der ersten großen Statinstudie von 1994 nie wieder erreicht wurden?
Ein Blick auf die harten Zahlen offenbart eine bemerkenswerte Diskrepanz zwischen der Vehemenz der Empfehlungen und der tatsächlichen Datenlage. Darüber hinaus stellt eine wachsende Zahl unabhängiger Wissenschaftler die zugrundeliegende Lipid-Hypothese – die kausale Verbindung zwischen Cholesterin und Atherosklerose – grundsätzlich in Frage. Diese fundamentale Kritik würde jedoch den Rahmen dieses Artikels sprengen; hier konzentrieren wir uns auf die Diskrepanz zwischen Empfehlungen und der verfügbaren Evidenz für Statine.
Der Fall der Statine dient dabei als exemplarisches Musterbeispiel dafür, dass die Grundlagen der modernen Medizin einer kontinuierlichen kritischen Prüfung bedürfen. Selbst etablierte Behandlungsstandards und offizielle Leitlinien, die das Arzt-Patient-Gespräch maßgeblich prägen, dürfen nicht als unumstößliche Wahrheiten betrachtet werden. Die stillschweigende Annahme, dass "alles schon seine Richtigkeit haben wird", wird der Komplexität medizinischer Entscheidungen und der Problematik einiger systemischer Angelegenheiten nicht gerecht.
Die große Cochrane-Ernüchterung
Die umfassendste und neutralste Bewertung von Statinen in der Primärprävention stammt aus der Cochrane Library, dem Goldstandard der evidenzbasierten Medizin. Die 2013 publizierte Meta-Analyse von Taylor et al. untersuchte 11 hochwertige randomisierte kontrollierte Studien mit insgesamt 65.229 Teilnehmern.
Das Ergebnis war ernüchternd: Statine zeigten in der Primärprävention keine statistisch signifikante Reduktion der Gesamtmortalität (Relatives Risiko 0,91; 95% Konfidenzintervall 0,83-1,01; p=0,09). Von allen untersuchten Endpunkten war dies der wichtigste – schließlich geht es letztendlich darum, Menschenleben zu retten.
Die oft zitierten "positiven" Effekte beschränkten sich auf zusammengesetzte Endpunkte wie "schwere kardiovaskuläre Ereignisse", bei denen auch nicht-tödliche Ereignisse mitgezählt werden. Selbst hier waren die absoluten Risikoreduktionen minimal: etwa 1,1% über mehrere Jahre Behandlungsdauer.
Absolute und relative Risiken verstehen
Die ASCOT-LLA-Studie mit 10.305 Teilnehmern zeigt, wie dieselben Daten völlig unterschiedlich dargestellt werden können:
Die Rohdaten:
Herzinfarkte mit Atorvastatin: 100 von 5.168 Teilnehmern (1,9%)
Herzinfarkte mit Placebo: 154 von 5.137 Teilnehmern (3,0%)
Verschiedene Darstellungsformen:
Absolute Risikoreduktion: 3,0% – 1,9% = 1,1 Prozentpunkte
Relative Risikoreduktion: (3,0% – 1,9%) ÷ 3,0% = 36%
Number Needed to Treat: 1 ÷ 0,011 = 91 (91 Menschen müssen behandelt werden, damit einer einen Herzinfarkt vermeidet)
In der medizinischen Literatur: "36%ige Reduktion des Herzinfarktrisikos"
In der Realität: Von 1000 behandelten Personen vermeiden 11 einen Herzinfarkt über 3,3 Jahre
Beide Darstellungen sind mathematisch korrekt. Die Wahl der Darstellungsform beeinflusst jedoch maßgeblich die Wahrnehmung des Nutzens.
Der historische Goldstandard: 4S und seine nie reproduzierten Ergebnisse
Die Scandinavian Simvastatin Survival Study (4S) Die Scandinavian Simvastatin Survival Study (4S) von 1994 gilt als Meilenstein der Statin-Forschung. 4.444 Patienten mit bereits bestehender koronarer Herzkrankheit erhielten entweder Simvastatin oder Placebo. Das Ergebnis schien spektakulär: eine absolute Mortalitätsreduktion von 3,3% über 5,4 Jahre – das entspricht etwa 0,6% pro Jahr.
Doch dieser Erfolg war nie wieder reproduzierbar. Die LIPID-Studie (1998) mit ähnlichem Design zeigte bereits nur noch die Hälfte dieses Effekts: 1,9% absolute Mortalitätsreduktion über 6 Jahre (0,32% pro Jahr).
Noch problematischer: Spätere Studien mit verbesserter Methodik zeigten oft gar keine Mortalitätsvorteile mehr. Die IDEAL-Studie (2005) verglich normale mit hohen Statindosen bei 8.888 Herzinfarktpatienten. Trotz deutlich stärkerer Cholesterinsenkung in der Hochdosis-Gruppe starben praktisch gleich viele Patienten: 374 versus 366.
Wenn mehr Cholesterinsenkung nicht zu weniger Todesfällen führt, muss die Grundhypothese "Je niedriger das Cholesterin, desto besser" hinterfragt werden.
Die Wende nach den Pharma-Skandalen
Ein bemerkenswerter Aspekt der Statin-Forschung ist die zeitliche Verteilung der Ergebnisse. Die größten Mortalitätsvorteile wurden in den 1990er und frühen 2000er Jahren berichtet, während spätere Studien trotz größerer Teilnehmerzahlen und längerer Nachbeobachtung schwächere oder keine Effekte zeigten. Diese Entwicklung fällt zeitlich mit zwei bedeutsamen Pharma-Skandalen zusammen.
Der Vioxx-Skandal (2004): Der Schmerzmittelhersteller Merck hatte Daten über erhöhte Herzinfarktrisiken unter Vioxx vor der FDA verheimlicht. Interne Dokumente belegten, dass das Unternehmen bereits 1999 um die Risiken wusste. Ein Geschworenengericht in Texas sprach einer Witwe 253 Millionen Dollar Schadenersatz zu. Merck zahlte schließlich 4,85 Milliarden Dollar zur Beilegung von Sammelklagen.
Der ENHANCE-Skandal (2007-2008): Merck und Schering-Plough führten eine Studie mit dem Cholesterinsenker Vytorin durch, der Simvastatin und Ezetimib kombiniert. Trotz einer um 25% stärkeren LDL-Cholesterin-Senkung zeigte sich paradoxerweise eine geringfügig größere Verdickung der Halsschlagader-Intima. Die Unternehmen weigerten sich monatelang, diese negativen Ergebnisse zu veröffentlichen, bis der Kongress und die FDA Druck ausübten.
Regulatorische Konsequenzen: Als direkte Reaktion auf diese Skandale führte der US-Senat 2008 die verpflichtende Registrierung aller klinischen Studien bei clinicaltrials.gov ein. Pharmaunternehmen konnten nun nicht mehr selektiv nur positive Studien veröffentlichen und negative Ergebnisse unterdrücken.
Diese zeitliche Koinzidenz ist bemerkenswert: Vor 2008 zeigten Statinstudien (4S, LIPID) Mortalitätsvorteile. Nach 2008 zeigten vergleichbare oder größere Studien (IDEAL, TNT, SPARCL) trotz verbesserter Studienqualität keine oder sogar negative Effekte auf die Mortalität.
Vulnerable Gruppen: Wenn Statine mehr schaden als nutzen
Besonders problematisch wird die schwache Evidenz bei Patientengruppen, die traditionell als "Hochrisiko" gelten und daher besonders aggressiv behandelt werden:
Dialysepatienten (4D-Studie): 1.255 Typ-2-Diabetiker an der Dialyse erhielten Atorvastatin oder Placebo. Obwohl diese Patienten das höchste kardiovaskuläre Risiko aller untersuchten Gruppen hatten, zeigte sich kein Nutzen. Sogar ein Trend zu höherer Mortalität war erkennbar.
Schlaganfallpatienten (SPARCL-Studie): Nach Schlaganfall oder TIA erhielten 4.731 Patienten Atorvastatin 80mg oder Placebo. Zwar traten weniger weitere Schlaganfälle auf, dafür stieg die Gesamtmortalität: 216 Todesfälle unter Atorvastatin versus 204 unter Placebo.
Herzinsuffizienz (GISSI-HF und CORONA): Zwei große Studien mit insgesamt über 7.000 Herzinsuffizienz-Patienten zeigten übereinstimmend keinen Nutzen von Statinen – obwohl diese Patienten besonders von einer Reduktion kardiovaskulärer Ereignisse profitieren sollten.
Das Nebenwirkungsprofil: Unterschätzte Risiken
Während der Nutzen von Statinen in der Primärprävention fraglich ist, sind die Nebenwirkungen real und häufiger als in klinischen Studien berichtet:
Diabetes-Risiko: Meta-Analysen zeigen übereinstimmend eine 9-12%ige Erhöhung des Diabetes-Risikos. In der JUPITER-Studie entwickelten 0,65% der Teilnehmer unter Rosuvastatin einen Diabetes, während nur 0,25% kardiovaskuläre Todesfälle vermieden wurden – mehr neue Diabetiker als vermiedene Todesfälle.
Muskelschmerzen: Muskelschmerzen und -schwäche (Myalgie) betreffen laut Praxisstudien deutlich mehr Patienten als in klinischen Studien berichtet – ein Unterschied, der durch das "Run-in-Phase"-Design erklärbar ist, bei dem unverträgliche Patienten vor der Randomisierung ausgeschlossen werden. Schwere Muskelschäden (Rhabdomyolyse) sind seltener, aber potentiell lebensbedrohlich.
Kognitive Beeinträchtigungen: Patienten berichten häufig über Gedächtnisprobleme, verlangsamtes Denken und Konzentrationsschwierigkeiten. Diese Symptome sind biologisch plausibel, da Statine die Cholesterinsynthese im Gehirn beeinträchtigen und Cholesterin für die Neuronfunktion essentiell ist. Besonders problematisch ist dies bei Schlaganfallpatienten, wo solche Effekte nie systematisch untersucht wurden.
Weitere dokumentierte Effekte: Katarakte, Nierenfunktionsstörungen und in der PROSPER-Studie eine statistisch signifikante Erhöhung der Krebsinzidenz.
Nebenwirkungen in der Praxis
Die Buettner-Studie (2012) mit über 7.000 Teilnehmern zeigte:
Muskelschmerzen traten signifikant häufiger bei Statinnutzern auf
Diabetes-Risiko ist laut Meta-Analysen um 9–12% erhöht
Kognitive Beeinträchtigungen werden regelmäßig berichtet, sind aber unzureichend untersucht
Leberwerte müssen bei 1–3% der Anwender überwacht werden
Dem gegenüber steht: Eine Number Needed to Treat von 125 in der Primärprävention
Die Anatomie des Bias: Wie Studien "positive" Ergebnisse produzieren
Die Diskrepanz zwischen schwacher Evidenz und starken Empfehlungen erklärt sich durch systematische Verzerrungen in der Studienplanung und -auswertung:
Studiendesign: In vielen Statinstudien gibt es eine "Run-in-Phase", in der Patienten, die das Medikament nicht vertragen, vor der eigentlichen Randomisierung ausgeschlossen werden. Das minimiert erkennbare Nebenwirkungen.
Endpunkt-Adjudizierung: Zentrale Komitees, die von den Herstellern bezahlt werden, entscheiden nachträglich, ob ein berichteter Herzinfarkt "wirklich" ein Herzinfarkt war. Dokumentierte Fälle aus der Fachliteratur zeigen, wie solche Komitees systematisch Ereignisse in der Behandlungsgruppe "weg-adjudizieren" und in der Placebogruppe "hinzu-adjudizieren".
Relative versus absolute Risiken: Die Betonung relativer Risikoreduktionen verschleiert die oft marginalen absoluten Effekte.
Diese Mechanismen erklären, warum Studien regelmäßig "positive" Ergebnisse zeigen, die bei genauer Betrachtung klinisch wenig relevant sind. Die strukturellen Probleme der pharmafinanzierten Forschung sind in der medizinischen Fachliteratur gut dokumentiert.
Leitlinien und Interessenskonflikte
Eine Analyse der Interessenskonflikte der 25 Hauptautoren der ESC/EAS-Leitlinien 2019 durch den Arzneimittelbrief zeigt ein bemerkenswertes Bild:
100% der Autoren haben finanzielle Verbindungen zur Pharmaindustrie
Durchschnittlich 6 Industriekontakte pro Autor
Honorare, Beratungsverträge, Forschungsgelder von praktisch allen großen Pharmakonzernen
Dieser Befund deckt sich mit kritischen Einschätzungen führender Medizinredakteure. Marcia Angell, 20 Jahre lang Chefredakteurin des New England Journal of Medicine, schrieb: "Es ist einfach nicht mehr möglich, einem Großteil der klinischen Forschung, die veröffentlicht wird, zu glauben oder sich auf das Urteil angesehener Ärzte oder maßgebliche medizinische Richtlinien zu verlassen". Ähnlich äußerte sich Richard Horton, Chefredakteur von The Lancet: "Ein Großteil der wissenschaftlichen Literatur, vielleicht die Hälfte, ist möglicherweise einfach unwahr" aufgrund von Interessenskonflikten.
Die systemischen Konsequenzen
Was hier am Beispiel der Statine sichtbar wird, ist ein systemisches Problem der modernen Medizin. Wenn die Evidenzbasis für weitverbreitete Therapien schwach ist, während gleichzeitig massive wirtschaftliche Interessen bestehen, entstehen Behandlungsempfehlungen, die mehr der Marktlogik als dem Patientenwohl folgen.
Strukturelle Interessenskonflikte prägen das System: Regulatory Capture, bei dem Aufsichtsbehörden von der zu überwachenden Industrie beeinflusst werden, ist ein bekanntes Phänomen. Medizinische Fachzeitschriften sind auf Werbeeinnahmen angewiesen. Fortbildungsveranstaltungen werden industriell gesponsert. Die Herausforderung, unter diesen Bedingungen unabhängige wissenschaftliche Bewertungen zu gewährleisten, wird in der medizinischen Fachliteratur intensiv diskutiert.
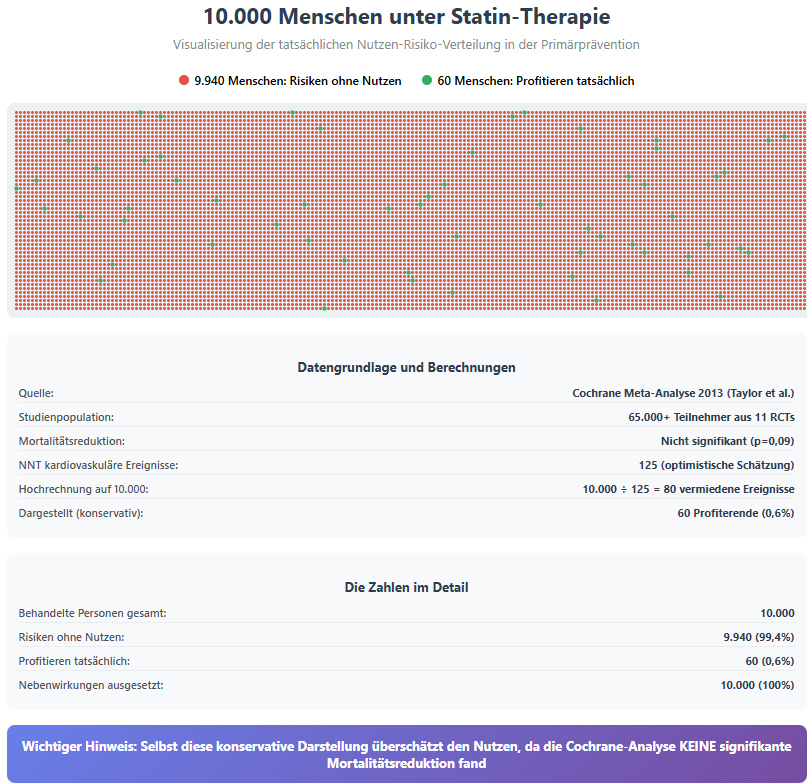
Von 10.000 Menschen, die ein Jahr lang ein Statin nehmen:
9.940 haben keinen Nutzen bezüglich Mortalität
60 profitieren möglicherweise (basierend auf optimistischen Schätzungen)
Alle 10.000 sind Nebenwirkungen ausgesetzt
Das Dilemma in der Praxis: Zwischen Leitlinien und Evidenz
Die hier dargestellte Diskrepanz zwischen schwacher Evidenz und starken Empfehlungen schafft eine schwierige Situation für Ärzte und Patienten gleichermaßen. Behandelnde Ärzte befinden sich in einem strukturellen Dilemma: Einerseits sind sie an offizielle Leitlinien gebunden, die Statine in der Primärprävention empfehlen. Andererseits zeigen die zugrundeliegenden Daten ein ernüchterndes Bild.
Haftungsrechtlich bewegen sich Ärzte auf sicherem Terrain, wenn sie leitlinienkonform behandeln – auch wenn die Evidenzbasis schwach ist. Eine Abweichung von den Leitlinien kann dagegen rechtliche Konsequenzen haben, selbst wenn sie medizinisch begründbar wäre. Dieser Mechanismus verstärkt die Anwendung von Therapien mit fraglichem Nutzen-Risiko-Verhältnis.
Für Patienten bedeutet dies: Eine fundierte Entscheidung erfordert mehr als das Vertrauen auf Leitlinienempfehlungen. Das Verständnis für absolute Risiken, die Kenntnis der Nebenwirkungen und das Bewusstsein für die Grenzen der verfügbaren Evidenz sind essentiell. Nur auf dieser Basis können gemeinsam mit dem behandelnden Arzt individuelle Therapieentscheidungen getroffen werden, die der persönlichen Risikokonstellaton gerecht werden.
Die Statingeschichte illustriert exemplarisch ein grundlegendes Problem der modernen Medizin: Wenn kommerzielle Interessen die Evidenzgenerierung dominieren, entstehen Behandlungsstandards, die mehr der Marktlogik als dem Patientenwohl folgen. Dieses Bewusstsein zu schärfen ist der erste Schritt zu einer rationaleren Medizin.
Literaturverzeichnis im Spoiler
Literaturverzeichnis
1. Taylor F, Huffman MD, Macedo AF, et al. Statins for the primary prevention of cardiovascular disease. Cochrane Database Syst Rev 2013;(1):CD004816. https://doi.org/10.1002/14651858.CD004816.pub5
Meta-Analyse von 11 Studien mit 65.000+ Teilnehmern: Keine signifikante Mortalitätsreduktion in Primärprävention
2. Scandinavian Simvastatin Survival Study Group. Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S). Lancet 1994;344(8934):1383-9. https://doi.org/10.1016/s0140-6736(94)90566-5
Erste große Statinstudie mit 0,6% absoluter Mortalitätsreduktion – nie wieder reproduziert
3. Prevention of cardiovascular events and death with pravastatin in patients with coronary heart disease and a broad range of initial cholesterol levels. The Long-Term Intervention with Pravastatin in Ischaemic Disease (LIPID) Study Group. N Engl J Med 1998;339(19):1349-57. https://doi.org/10.1056/NEJM199811053391902
Nur halber Mortalitätsvorteil der 4S-Studie trotz ähnlichem Design
4. Pedersen TR, Faergeman O, Kastelein JJ, et al. High-dose atorvastatin vs usual-dose simvastatin for secondary prevention after myocardial infarction: the IDEAL study: a randomized controlled trial. JAMA 2005;294(19):2437-45. https://doi.org/10.1001/jama.294.19.2437
Stärkere Cholesterinsenkung ohne Mortalitätsvorteil (374 vs. 366 Todesfälle)
5. LaRosa JC, Grundy SM, Waters DD, et al. Intensive lipid lowering with atorvastatin in patients with stable coronary disease. N Engl J Med 2005;352(14):1425-35. https://doi.org/10.1056/NEJMoa050461
10mg vs. 80mg Atorvastatin: identische Mortalität trotz unterschiedlicher Cholesterinsenkung
6. Sever PS, Dahlöf B, Poulter NR, et al. Prevention of coronary and stroke events with atorvastatin in hypertensive patients who have average or lower-than-average cholesterol concentrations, in the Anglo-Scandinavian Cardiac Outcomes Trial--Lipid Lowering Arm (ASCOT-LLA): a multicentre randomised controlled trial. Lancet 2003;361(9364):1149-58. https://doi.org/10.1016/S0140-6736(03)12948-0
1,1% absolute Risikoreduktion wird als "36% Reduktion" vermarktet
7. Amarenco P, Bogousslavsky J, Callahan A 3rd, et al. High-dose atorvastatin after stroke or transient ischemic attack. N Engl J Med 2006;355(6):549-59. https://doi.org/10.1056/NEJMoa061894
Höhere Gesamtmortalität in Statin-Gruppe bei Schlaganfallpatienten
8. Wanner C, Krane V, März W, et al. Atorvastatin in patients with type 2 diabetes mellitus undergoing hemodialysis. N Engl J Med 2005;353(3):238-48. https://doi.org/10.1056/NEJMoa043545
Kein Nutzen bei Dialysepatienten trotz höchstem kardiovaskulärem Risiko
9. Tavazzi L, Maggioni AP, Marchioli R, et al. Effect of rosuvastatin in patients with chronic heart failure (the GISSI-HF trial): a randomised, double-blind, placebo-controlled trial. Lancet 2008;372(9645):1231-9. https://doi.org/10.1016/S0140-6736(08)61240-4
Kein Nutzen von Statinen bei Herzinsuffizienz
10. Kjekshus J, Apetrei E, Barrios V, et al. Rosuvastatin in older patients with systolic heart failure. N Engl J Med 2007;357(22):2248-61. https://doi.org/10.1056/NEJMoa0706201
Bestätigung: Kein Nutzen von Statinen bei Herzinsuffizienz
11. Mach F, Baigent C, Catapano AL, et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J 2020;41(1):111-188. https://doi.org/10.1093/eurheartj/ehz455
Europäische Leitlinien mit massiven Interessenskonflikten der Autoren
12. Der Arzneimittelbrief. Interessenkonflikte bei den Autoren der ESC/EAS-Leitlinien 2019 zur Behandlung von Dyslipidämien. AMB 2019;53:89. https://www.der-arzneimittelbrief.de/de/Artikel.aspx?J=2019&S=89
Analyse: Alle 25 Leitlinienautoren haben finanzielle Verbindungen zur Pharmaindustrie
13. Ridker PM, Danielson E, Fonseca FA, et al. Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein. N Engl J Med 2008;359(21):2195-207. https://doi.org/10.1056/NEJMoa0807646
JUPITER-Studie: Mehr neue Diabetiker (0,65%) als vermiedene kardiovaskuläre Todesfälle (0,25%)
14. Diamond DM, Ravnskov U. How statistical deception created the appearance that statins are safe and effective in primary and secondary prevention of cardiovascular disease. Expert Rev Clin Pharmacol 2015;8(2):201-10. https://doi.org/10.1586/17512433.2015.1012494
Systematische Analyse der statistischen Verzerrungen in Statinstudien
15. Sattar N, Preiss D, Murray HM, et al. Risk of incident diabetes with intensive-dose compared with moderate-dose statin therapy: a meta-analysis. JAMA 2011;305(24):2556-64. https://doi.org/10.1001/jama.2011.860
12% erhöhtes Diabetesrisiko bei intensiver Statintherapie
16. Preiss D, Seshasai SR, Welsh P, et al. Risk of incident diabetes with statin use: a collaborative meta-analysis of randomised statin trials. Lancet 2010;375(9716):735-42. https://doi.org/10.1016/S0140-6736(09)61965-6
Grundlagen-Meta-Analyse: 9% erhöhtes Diabetesrisiko durch Statine
17. Buettner C, Rippberger MJ, Smith JK, et al. Statin use and musculoskeletal pain among adults with and without arthritis. Am J Med 2012;125(2):176-82. https://doi.org/10.1016/j.amjmed.2011.08.007
Reale Muskelschmerzen bei 10–25% der Anwender in der Praxis
18. Golomb BA, Evans MA. Statin adverse effects: a review of the literature and evidence for a mitochondrial mechanism. Am J Cardiovasc Drugs 2008;8(6):373-418. https://doi.org/10.2165/0129784-200808060-00004
Umfassender Review zu Statinnebenwirkungen und biologischen Mechanismen
19. Shepherd J, Blauw GJ, Murphy MB, et al. Pravastatin in elderly individuals at risk of vascular disease (PROSPER): a randomised controlled trial. Lancet 2002;360(9346):1623-30. https://doi.org/10.1016/s0140-6736(02)11600-x
25% erhöhte Krebsinzidenz unter Statintherapie
20. Wagstaff LR, Mitton MW, Arvik BM, Doraiswamy PM. Statin-associated memory loss: analysis of 60 case reports and review of the literature. Pharmacotherapy 2003;23(7):871-80. https://doi.org/10.1592/phco.23.7.871.32720
Dokumentierte kognitive Beeinträchtigungen und Gedächtnisverlust durch Statine
21. Topol EJ. Failing the public health--rofecoxib, Merck, and the FDA. N Engl J Med 2004;351(17):1707-9. https://doi.org/10.1056/NEJMp048286
Analyse des Vioxx-Skandals und des Versagens der FDA-Überwachung
22. Kastelein JJ, Akdim F, Stroes ES, et al. Simvastatin with or without ezetimibe in familial hypercholesterolemia. N Engl J Med 2008;358(14):1431-43. https://doi.org/10.1056/NEJMoa0800742
ENHANCE-Studie: Stärkere Cholesterinsenkung mit paradoxer Plaque-Zunahme
23. Berenson A. Drug makers face assault on prices. New York Times 2008 Mar 6. https://www.nytimes.com/2008/03/06/business/06drug.html
Journalistische Aufarbeitung der ENHANCE-Vertuschung und Kongressanhörungen
24. Angell M. Drug companies & doctors: a story of corruption. N Engl J Med 2009;360(18):1895-6.https://doi.org/10.1056/NEJMp0905565
Marcia Angell über die Korruption der klinischen Forschung durch Pharmaindustrie
25. Horton R. Offline: What is medicine's 5 sigma? Lancet 2015;385(9976):1380. https://doi.org/10.1016/S0140-6736(15)60696-1
Richard Horton über die Unzuverlässigkeit der medizinischen Literatur
26. Simes RJ. Prospective meta-analysis of cholesterol-lowering studies: the Prospective Pravastatin Pooling (PPP) Project and the Cholesterol Treatment Trialists (CTT) Collaboration. Am J Cardiol 1995;76(9):122C-126C.https://doi.org/10.1016/0197-2456(94)00054-X
Methodische Analyse der Run-in-Phasen in Cholesterinstudien
27. Associated Press. Merck agrees to pay $4.85 billion in Vioxx settlement. USA Today 2007 Nov 9. https://usatoday30.usatoday.com/money/industries/health/drugs/2007-11-09-merck-vioxx_N.htm
Offizielle Berichterstattung über die 4,85 Milliarden Dollar Vioxx-Vergleichszahlung
KI-Disclaimer im Spoiler
Für die Erstellung dieses Beitrags habe ich Claude Sonnet 4 (Anthropic) als technisches Werkzeug eingesetzt, um zu recherchieren, zu strukturieren, zu formatieren und die wissenschaftliche Literatur zu analysieren. Dabei habe ich die Inhalte inhaltlich vollständig selbst bestimmt und gesteuert. Die KI diente ausschließlich als Assistenz zur Umsetzung meiner konkreten Vorgaben. Die KI unterstützte lediglich bei der technischen Umsetzung meiner Anweisungen. Somit handelt es sich bei dem vorliegenden Text um eine eigenständige Leistung, bei der KI-Tools lediglich als Hilfsmittel zur Effizienzsteigerung genutzt wurden. Dieser Disclaimer entspricht den aktuellen Empfehlungen zur transparenten Kennzeichnung von KI-Nutzung in wissenschaftlichen und publizistischen Kontexten.
Statine als Exempel für Probleme von Wissenschaftlichkeit und Evidenz in der Medizin.
Dies ist nur ein Archiv, die Diskussionen zu den Themen sollen in geeigneten Threads im Forum stattfinden.
Dies ist keine medizinische Beratung! Persönliche Entscheidungen zur Behandlung und Medikamenteneinnahme müssen unter ärztlicher Beratung stattfinden. Dies findet hier im Forum nicht statt.
Wichtiger Hinweis: Dies ist zum gegenwärtigen Zeitpunkt noch eine Vorabversion zu einer These in der noch nicht alles final ausformuliert und mehrfach gegengeprüft und formatiert ist. Dies geschieht jetzt sukzessive. Alle Links zu Quellen finden sich gesammelt im Literaturverzeichnis am Ende. Ein großes Problem ist, dass man nicht genug in die Tiefe gehen kann, ohne eine vollwertige Studie zu erarbeiten. Und das würde hier ja weit über das Machbare hinausgehen. Zu allem gibt es, wenn man es prüft, ein Wenn und Aber. Das ist nicht mehr darstellbar, dabei geht der Faden der kompakten Zusammenfassung verloren. eigentlich kann es nur darum gehen, eine These einigermaßen solide in den Raum zu stellen. Dafür ist das Thema leider ein problematisches Feld. Am Ende kann die These doch wieder als gerechtfertigt dastehen, obwohl sie zwischenzeitlich zu kippen schien. Auch kommt es in vielen Punkten auf die exakte Fragestellung an: Für wen genau ist in welcher Situation genau welche Intervention indiziert etc. Hier steht Promärprävention als Motto drüber, das kann aber auch schnell aus den Augen verloren werden und wir vermischen es im Eifer des Gefechtes mit diversen klinischen Szenarios. Die Ausarbeitung steht also noch unter starken Vorbehalten.
Statine in der Primärprävention: Schwache Evidenz aber starke Empfehlungen
Statine gelten als Goldstandard der Herzinfarkt-Prävention. Millionen Menschen nehmen diese verschreibungspflichtigen Cholesterinsenker täglich ein, auf ärztliche Empfehlung und gestützt auf internationale Leitlinien. Doch was passiert, wenn man die zugrundeliegenden Studien genauer betrachtet? Wenn man absolute statt relative Risiken analysiert? Und wenn man fragt, warum die spektakulären Ergebnisse der ersten großen Statinstudie von 1994 nie wieder erreicht wurden?
Ein Blick auf die harten Zahlen offenbart eine bemerkenswerte Diskrepanz zwischen der Vehemenz der Empfehlungen und der tatsächlichen Datenlage. Darüber hinaus stellt eine wachsende Zahl unabhängiger Wissenschaftler die zugrundeliegende Lipid-Hypothese – die kausale Verbindung zwischen Cholesterin und Atherosklerose – grundsätzlich in Frage. Diese fundamentale Kritik würde jedoch den Rahmen dieses Artikels sprengen; hier konzentrieren wir uns auf die Diskrepanz zwischen Empfehlungen und der verfügbaren Evidenz für Statine.
Der Fall der Statine dient dabei als exemplarisches Musterbeispiel dafür, dass die Grundlagen der modernen Medizin einer kontinuierlichen kritischen Prüfung bedürfen. Selbst etablierte Behandlungsstandards und offizielle Leitlinien, die das Arzt-Patient-Gespräch maßgeblich prägen, dürfen nicht als unumstößliche Wahrheiten betrachtet werden. Die stillschweigende Annahme, dass "alles schon seine Richtigkeit haben wird", wird der Komplexität medizinischer Entscheidungen und der Problematik einiger systemischer Angelegenheiten nicht gerecht.
Die große Cochrane-Ernüchterung
Die umfassendste und neutralste Bewertung von Statinen in der Primärprävention stammt aus der Cochrane Library, dem Goldstandard der evidenzbasierten Medizin. Die 2013 publizierte Meta-Analyse von Taylor et al. untersuchte 11 hochwertige randomisierte kontrollierte Studien mit insgesamt 65.229 Teilnehmern.
Das Ergebnis war ernüchternd: Statine zeigten in der Primärprävention keine statistisch signifikante Reduktion der Gesamtmortalität (Relatives Risiko 0,91; 95% Konfidenzintervall 0,83-1,01; p=0,09). Von allen untersuchten Endpunkten war dies der wichtigste – schließlich geht es letztendlich darum, Menschenleben zu retten.
Die oft zitierten "positiven" Effekte beschränkten sich auf zusammengesetzte Endpunkte wie "schwere kardiovaskuläre Ereignisse", bei denen auch nicht-tödliche Ereignisse mitgezählt werden. Selbst hier waren die absoluten Risikoreduktionen minimal: etwa 1,1% über mehrere Jahre Behandlungsdauer.
Absolute und relative Risiken verstehen
Die ASCOT-LLA-Studie mit 10.305 Teilnehmern zeigt, wie dieselben Daten völlig unterschiedlich dargestellt werden können:
Die Rohdaten:
Herzinfarkte mit Atorvastatin: 100 von 5.168 Teilnehmern (1,9%)
Herzinfarkte mit Placebo: 154 von 5.137 Teilnehmern (3,0%)
Verschiedene Darstellungsformen:
Absolute Risikoreduktion: 3,0% – 1,9% = 1,1 Prozentpunkte
Relative Risikoreduktion: (3,0% – 1,9%) ÷ 3,0% = 36%
Number Needed to Treat: 1 ÷ 0,011 = 91 (91 Menschen müssen behandelt werden, damit einer einen Herzinfarkt vermeidet)
In der medizinischen Literatur: "36%ige Reduktion des Herzinfarktrisikos"
In der Realität: Von 1000 behandelten Personen vermeiden 11 einen Herzinfarkt über 3,3 Jahre
Beide Darstellungen sind mathematisch korrekt. Die Wahl der Darstellungsform beeinflusst jedoch maßgeblich die Wahrnehmung des Nutzens.
Der historische Goldstandard: 4S und seine nie reproduzierten Ergebnisse
Die Scandinavian Simvastatin Survival Study (4S) Die Scandinavian Simvastatin Survival Study (4S) von 1994 gilt als Meilenstein der Statin-Forschung. 4.444 Patienten mit bereits bestehender koronarer Herzkrankheit erhielten entweder Simvastatin oder Placebo. Das Ergebnis schien spektakulär: eine absolute Mortalitätsreduktion von 3,3% über 5,4 Jahre – das entspricht etwa 0,6% pro Jahr.
Doch dieser Erfolg war nie wieder reproduzierbar. Die LIPID-Studie (1998) mit ähnlichem Design zeigte bereits nur noch die Hälfte dieses Effekts: 1,9% absolute Mortalitätsreduktion über 6 Jahre (0,32% pro Jahr).
Noch problematischer: Spätere Studien mit verbesserter Methodik zeigten oft gar keine Mortalitätsvorteile mehr. Die IDEAL-Studie (2005) verglich normale mit hohen Statindosen bei 8.888 Herzinfarktpatienten. Trotz deutlich stärkerer Cholesterinsenkung in der Hochdosis-Gruppe starben praktisch gleich viele Patienten: 374 versus 366.
Wenn mehr Cholesterinsenkung nicht zu weniger Todesfällen führt, muss die Grundhypothese "Je niedriger das Cholesterin, desto besser" hinterfragt werden.
Die Wende nach den Pharma-Skandalen
Ein bemerkenswerter Aspekt der Statin-Forschung ist die zeitliche Verteilung der Ergebnisse. Die größten Mortalitätsvorteile wurden in den 1990er und frühen 2000er Jahren berichtet, während spätere Studien trotz größerer Teilnehmerzahlen und längerer Nachbeobachtung schwächere oder keine Effekte zeigten. Diese Entwicklung fällt zeitlich mit zwei bedeutsamen Pharma-Skandalen zusammen.
Der Vioxx-Skandal (2004): Der Schmerzmittelhersteller Merck hatte Daten über erhöhte Herzinfarktrisiken unter Vioxx vor der FDA verheimlicht. Interne Dokumente belegten, dass das Unternehmen bereits 1999 um die Risiken wusste. Ein Geschworenengericht in Texas sprach einer Witwe 253 Millionen Dollar Schadenersatz zu. Merck zahlte schließlich 4,85 Milliarden Dollar zur Beilegung von Sammelklagen.
Der ENHANCE-Skandal (2007-2008): Merck und Schering-Plough führten eine Studie mit dem Cholesterinsenker Vytorin durch, der Simvastatin und Ezetimib kombiniert. Trotz einer um 25% stärkeren LDL-Cholesterin-Senkung zeigte sich paradoxerweise eine geringfügig größere Verdickung der Halsschlagader-Intima. Die Unternehmen weigerten sich monatelang, diese negativen Ergebnisse zu veröffentlichen, bis der Kongress und die FDA Druck ausübten.
Regulatorische Konsequenzen: Als direkte Reaktion auf diese Skandale führte der US-Senat 2008 die verpflichtende Registrierung aller klinischen Studien bei clinicaltrials.gov ein. Pharmaunternehmen konnten nun nicht mehr selektiv nur positive Studien veröffentlichen und negative Ergebnisse unterdrücken.
Diese zeitliche Koinzidenz ist bemerkenswert: Vor 2008 zeigten Statinstudien (4S, LIPID) Mortalitätsvorteile. Nach 2008 zeigten vergleichbare oder größere Studien (IDEAL, TNT, SPARCL) trotz verbesserter Studienqualität keine oder sogar negative Effekte auf die Mortalität.
Vulnerable Gruppen: Wenn Statine mehr schaden als nutzen
Besonders problematisch wird die schwache Evidenz bei Patientengruppen, die traditionell als "Hochrisiko" gelten und daher besonders aggressiv behandelt werden:
Dialysepatienten (4D-Studie): 1.255 Typ-2-Diabetiker an der Dialyse erhielten Atorvastatin oder Placebo. Obwohl diese Patienten das höchste kardiovaskuläre Risiko aller untersuchten Gruppen hatten, zeigte sich kein Nutzen. Sogar ein Trend zu höherer Mortalität war erkennbar.
Schlaganfallpatienten (SPARCL-Studie): Nach Schlaganfall oder TIA erhielten 4.731 Patienten Atorvastatin 80mg oder Placebo. Zwar traten weniger weitere Schlaganfälle auf, dafür stieg die Gesamtmortalität: 216 Todesfälle unter Atorvastatin versus 204 unter Placebo.
Herzinsuffizienz (GISSI-HF und CORONA): Zwei große Studien mit insgesamt über 7.000 Herzinsuffizienz-Patienten zeigten übereinstimmend keinen Nutzen von Statinen – obwohl diese Patienten besonders von einer Reduktion kardiovaskulärer Ereignisse profitieren sollten.
Das Nebenwirkungsprofil: Unterschätzte Risiken
Während der Nutzen von Statinen in der Primärprävention fraglich ist, sind die Nebenwirkungen real und häufiger als in klinischen Studien berichtet:
Diabetes-Risiko: Meta-Analysen zeigen übereinstimmend eine 9-12%ige Erhöhung des Diabetes-Risikos. In der JUPITER-Studie entwickelten 0,65% der Teilnehmer unter Rosuvastatin einen Diabetes, während nur 0,25% kardiovaskuläre Todesfälle vermieden wurden – mehr neue Diabetiker als vermiedene Todesfälle.
Muskelschmerzen: Muskelschmerzen und -schwäche (Myalgie) betreffen laut Praxisstudien deutlich mehr Patienten als in klinischen Studien berichtet – ein Unterschied, der durch das "Run-in-Phase"-Design erklärbar ist, bei dem unverträgliche Patienten vor der Randomisierung ausgeschlossen werden. Schwere Muskelschäden (Rhabdomyolyse) sind seltener, aber potentiell lebensbedrohlich.
Kognitive Beeinträchtigungen: Patienten berichten häufig über Gedächtnisprobleme, verlangsamtes Denken und Konzentrationsschwierigkeiten. Diese Symptome sind biologisch plausibel, da Statine die Cholesterinsynthese im Gehirn beeinträchtigen und Cholesterin für die Neuronfunktion essentiell ist. Besonders problematisch ist dies bei Schlaganfallpatienten, wo solche Effekte nie systematisch untersucht wurden.
Weitere dokumentierte Effekte: Katarakte, Nierenfunktionsstörungen und in der PROSPER-Studie eine statistisch signifikante Erhöhung der Krebsinzidenz.
Nebenwirkungen in der Praxis
Die Buettner-Studie (2012) mit über 7.000 Teilnehmern zeigte:
Muskelschmerzen traten signifikant häufiger bei Statinnutzern auf
Diabetes-Risiko ist laut Meta-Analysen um 9–12% erhöht
Kognitive Beeinträchtigungen werden regelmäßig berichtet, sind aber unzureichend untersucht
Leberwerte müssen bei 1–3% der Anwender überwacht werden
Dem gegenüber steht: Eine Number Needed to Treat von 125 in der Primärprävention
Die Anatomie des Bias: Wie Studien "positive" Ergebnisse produzieren
Die Diskrepanz zwischen schwacher Evidenz und starken Empfehlungen erklärt sich durch systematische Verzerrungen in der Studienplanung und -auswertung:
Studiendesign: In vielen Statinstudien gibt es eine "Run-in-Phase", in der Patienten, die das Medikament nicht vertragen, vor der eigentlichen Randomisierung ausgeschlossen werden. Das minimiert erkennbare Nebenwirkungen.
Endpunkt-Adjudizierung: Zentrale Komitees, die von den Herstellern bezahlt werden, entscheiden nachträglich, ob ein berichteter Herzinfarkt "wirklich" ein Herzinfarkt war. Dokumentierte Fälle aus der Fachliteratur zeigen, wie solche Komitees systematisch Ereignisse in der Behandlungsgruppe "weg-adjudizieren" und in der Placebogruppe "hinzu-adjudizieren".
Relative versus absolute Risiken: Die Betonung relativer Risikoreduktionen verschleiert die oft marginalen absoluten Effekte.
Diese Mechanismen erklären, warum Studien regelmäßig "positive" Ergebnisse zeigen, die bei genauer Betrachtung klinisch wenig relevant sind. Die strukturellen Probleme der pharmafinanzierten Forschung sind in der medizinischen Fachliteratur gut dokumentiert.
Leitlinien und Interessenskonflikte
Eine Analyse der Interessenskonflikte der 25 Hauptautoren der ESC/EAS-Leitlinien 2019 durch den Arzneimittelbrief zeigt ein bemerkenswertes Bild:
100% der Autoren haben finanzielle Verbindungen zur Pharmaindustrie
Durchschnittlich 6 Industriekontakte pro Autor
Honorare, Beratungsverträge, Forschungsgelder von praktisch allen großen Pharmakonzernen
Dieser Befund deckt sich mit kritischen Einschätzungen führender Medizinredakteure. Marcia Angell, 20 Jahre lang Chefredakteurin des New England Journal of Medicine, schrieb: "Es ist einfach nicht mehr möglich, einem Großteil der klinischen Forschung, die veröffentlicht wird, zu glauben oder sich auf das Urteil angesehener Ärzte oder maßgebliche medizinische Richtlinien zu verlassen". Ähnlich äußerte sich Richard Horton, Chefredakteur von The Lancet: "Ein Großteil der wissenschaftlichen Literatur, vielleicht die Hälfte, ist möglicherweise einfach unwahr" aufgrund von Interessenskonflikten.
Die systemischen Konsequenzen
Was hier am Beispiel der Statine sichtbar wird, ist ein systemisches Problem der modernen Medizin. Wenn die Evidenzbasis für weitverbreitete Therapien schwach ist, während gleichzeitig massive wirtschaftliche Interessen bestehen, entstehen Behandlungsempfehlungen, die mehr der Marktlogik als dem Patientenwohl folgen.
Strukturelle Interessenskonflikte prägen das System: Regulatory Capture, bei dem Aufsichtsbehörden von der zu überwachenden Industrie beeinflusst werden, ist ein bekanntes Phänomen. Medizinische Fachzeitschriften sind auf Werbeeinnahmen angewiesen. Fortbildungsveranstaltungen werden industriell gesponsert. Die Herausforderung, unter diesen Bedingungen unabhängige wissenschaftliche Bewertungen zu gewährleisten, wird in der medizinischen Fachliteratur intensiv diskutiert.
Von 10.000 Menschen, die ein Jahr lang ein Statin nehmen:
9.940 haben keinen Nutzen bezüglich Mortalität
60 profitieren möglicherweise (basierend auf optimistischen Schätzungen)
Alle 10.000 sind Nebenwirkungen ausgesetzt

Das Dilemma in der Praxis: Zwischen Leitlinien und Evidenz
Die hier dargestellte Diskrepanz zwischen schwacher Evidenz und starken Empfehlungen schafft eine schwierige Situation für Ärzte und Patienten gleichermaßen. Behandelnde Ärzte befinden sich in einem strukturellen Dilemma: Einerseits sind sie an offizielle Leitlinien gebunden, die Statine in der Primärprävention empfehlen. Andererseits zeigen die zugrundeliegenden Daten ein ernüchterndes Bild.
Haftungsrechtlich bewegen sich Ärzte auf sicherem Terrain, wenn sie leitlinienkonform behandeln – auch wenn die Evidenzbasis schwach ist. Eine Abweichung von den Leitlinien kann dagegen rechtliche Konsequenzen haben, selbst wenn sie medizinisch begründbar wäre. Dieser Mechanismus verstärkt die Anwendung von Therapien mit fraglichem Nutzen-Risiko-Verhältnis.
Für Patienten bedeutet dies: Eine fundierte Entscheidung erfordert mehr als das Vertrauen auf Leitlinienempfehlungen. Das Verständnis für absolute Risiken, die Kenntnis der Nebenwirkungen und das Bewusstsein für die Grenzen der verfügbaren Evidenz sind essentiell. Nur auf dieser Basis können gemeinsam mit dem behandelnden Arzt individuelle Therapieentscheidungen getroffen werden, die der persönlichen Risikokonstellaton gerecht werden.
Die Statingeschichte illustriert exemplarisch ein grundlegendes Problem der modernen Medizin: Wenn kommerzielle Interessen die Evidenzgenerierung dominieren, entstehen Behandlungsstandards, die mehr der Marktlogik als dem Patientenwohl folgen. Dieses Bewusstsein zu schärfen ist der erste Schritt zu einer rationaleren Medizin.
Literaturverzeichnis im Spoiler
Literaturverzeichnis
1. Taylor F, Huffman MD, Macedo AF, et al. Statins for the primary prevention of cardiovascular disease. Cochrane Database Syst Rev 2013;(1):CD004816. https://doi.org/10.1002/14651858.CD004816.pub5
Meta-Analyse von 11 Studien mit 65.000+ Teilnehmern: Keine signifikante Mortalitätsreduktion in Primärprävention
2. Scandinavian Simvastatin Survival Study Group. Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S). Lancet 1994;344(8934):1383-9. https://doi.org/10.1016/s0140-6736(94)90566-5
Erste große Statinstudie mit 0,6% absoluter Mortalitätsreduktion – nie wieder reproduziert
3. Prevention of cardiovascular events and death with pravastatin in patients with coronary heart disease and a broad range of initial cholesterol levels. The Long-Term Intervention with Pravastatin in Ischaemic Disease (LIPID) Study Group. N Engl J Med 1998;339(19):1349-57. https://doi.org/10.1056/NEJM199811053391902
Nur halber Mortalitätsvorteil der 4S-Studie trotz ähnlichem Design
4. Pedersen TR, Faergeman O, Kastelein JJ, et al. High-dose atorvastatin vs usual-dose simvastatin for secondary prevention after myocardial infarction: the IDEAL study: a randomized controlled trial. JAMA 2005;294(19):2437-45. https://doi.org/10.1001/jama.294.19.2437
Stärkere Cholesterinsenkung ohne Mortalitätsvorteil (374 vs. 366 Todesfälle)
5. LaRosa JC, Grundy SM, Waters DD, et al. Intensive lipid lowering with atorvastatin in patients with stable coronary disease. N Engl J Med 2005;352(14):1425-35. https://doi.org/10.1056/NEJMoa050461
10mg vs. 80mg Atorvastatin: identische Mortalität trotz unterschiedlicher Cholesterinsenkung
6. Sever PS, Dahlöf B, Poulter NR, et al. Prevention of coronary and stroke events with atorvastatin in hypertensive patients who have average or lower-than-average cholesterol concentrations, in the Anglo-Scandinavian Cardiac Outcomes Trial--Lipid Lowering Arm (ASCOT-LLA): a multicentre randomised controlled trial. Lancet 2003;361(9364):1149-58. https://doi.org/10.1016/S0140-6736(03)12948-0
1,1% absolute Risikoreduktion wird als "36% Reduktion" vermarktet
7. Amarenco P, Bogousslavsky J, Callahan A 3rd, et al. High-dose atorvastatin after stroke or transient ischemic attack. N Engl J Med 2006;355(6):549-59. https://doi.org/10.1056/NEJMoa061894
Höhere Gesamtmortalität in Statin-Gruppe bei Schlaganfallpatienten
8. Wanner C, Krane V, März W, et al. Atorvastatin in patients with type 2 diabetes mellitus undergoing hemodialysis. N Engl J Med 2005;353(3):238-48. https://doi.org/10.1056/NEJMoa043545
Kein Nutzen bei Dialysepatienten trotz höchstem kardiovaskulärem Risiko
9. Tavazzi L, Maggioni AP, Marchioli R, et al. Effect of rosuvastatin in patients with chronic heart failure (the GISSI-HF trial): a randomised, double-blind, placebo-controlled trial. Lancet 2008;372(9645):1231-9. https://doi.org/10.1016/S0140-6736(08)61240-4
Kein Nutzen von Statinen bei Herzinsuffizienz
10. Kjekshus J, Apetrei E, Barrios V, et al. Rosuvastatin in older patients with systolic heart failure. N Engl J Med 2007;357(22):2248-61. https://doi.org/10.1056/NEJMoa0706201
Bestätigung: Kein Nutzen von Statinen bei Herzinsuffizienz
11. Mach F, Baigent C, Catapano AL, et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J 2020;41(1):111-188. https://doi.org/10.1093/eurheartj/ehz455
Europäische Leitlinien mit massiven Interessenskonflikten der Autoren
12. Der Arzneimittelbrief. Interessenkonflikte bei den Autoren der ESC/EAS-Leitlinien 2019 zur Behandlung von Dyslipidämien. AMB 2019;53:89. https://www.der-arzneimittelbrief.de/de/Artikel.aspx?J=2019&S=89
Analyse: Alle 25 Leitlinienautoren haben finanzielle Verbindungen zur Pharmaindustrie
13. Ridker PM, Danielson E, Fonseca FA, et al. Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein. N Engl J Med 2008;359(21):2195-207. https://doi.org/10.1056/NEJMoa0807646
JUPITER-Studie: Mehr neue Diabetiker (0,65%) als vermiedene kardiovaskuläre Todesfälle (0,25%)
14. Diamond DM, Ravnskov U. How statistical deception created the appearance that statins are safe and effective in primary and secondary prevention of cardiovascular disease. Expert Rev Clin Pharmacol 2015;8(2):201-10. https://doi.org/10.1586/17512433.2015.1012494
Systematische Analyse der statistischen Verzerrungen in Statinstudien
15. Sattar N, Preiss D, Murray HM, et al. Risk of incident diabetes with intensive-dose compared with moderate-dose statin therapy: a meta-analysis. JAMA 2011;305(24):2556-64. https://doi.org/10.1001/jama.2011.860
12% erhöhtes Diabetesrisiko bei intensiver Statintherapie
16. Preiss D, Seshasai SR, Welsh P, et al. Risk of incident diabetes with statin use: a collaborative meta-analysis of randomised statin trials. Lancet 2010;375(9716):735-42. https://doi.org/10.1016/S0140-6736(09)61965-6
Grundlagen-Meta-Analyse: 9% erhöhtes Diabetesrisiko durch Statine
17. Buettner C, Rippberger MJ, Smith JK, et al. Statin use and musculoskeletal pain among adults with and without arthritis. Am J Med 2012;125(2):176-82. https://doi.org/10.1016/j.amjmed.2011.08.007
Reale Muskelschmerzen bei 10–25% der Anwender in der Praxis
18. Golomb BA, Evans MA. Statin adverse effects: a review of the literature and evidence for a mitochondrial mechanism. Am J Cardiovasc Drugs 2008;8(6):373-418. https://doi.org/10.2165/0129784-200808060-00004
Umfassender Review zu Statinnebenwirkungen und biologischen Mechanismen
19. Shepherd J, Blauw GJ, Murphy MB, et al. Pravastatin in elderly individuals at risk of vascular disease (PROSPER): a randomised controlled trial. Lancet 2002;360(9346):1623-30. https://doi.org/10.1016/s0140-6736(02)11600-x
25% erhöhte Krebsinzidenz unter Statintherapie
20. Wagstaff LR, Mitton MW, Arvik BM, Doraiswamy PM. Statin-associated memory loss: analysis of 60 case reports and review of the literature. Pharmacotherapy 2003;23(7):871-80. https://doi.org/10.1592/phco.23.7.871.32720
Dokumentierte kognitive Beeinträchtigungen und Gedächtnisverlust durch Statine
21. Topol EJ. Failing the public health--rofecoxib, Merck, and the FDA. N Engl J Med 2004;351(17):1707-9. https://doi.org/10.1056/NEJMp048286
Analyse des Vioxx-Skandals und des Versagens der FDA-Überwachung
22. Kastelein JJ, Akdim F, Stroes ES, et al. Simvastatin with or without ezetimibe in familial hypercholesterolemia. N Engl J Med 2008;358(14):1431-43. https://doi.org/10.1056/NEJMoa0800742
ENHANCE-Studie: Stärkere Cholesterinsenkung mit paradoxer Plaque-Zunahme
23. Berenson A. Drug makers face assault on prices. New York Times 2008 Mar 6. https://www.nytimes.com/2008/03/06/business/06drug.html
Journalistische Aufarbeitung der ENHANCE-Vertuschung und Kongressanhörungen
24. Angell M. Drug companies & doctors: a story of corruption. N Engl J Med 2009;360(18):1895-6.
Marcia Angell über die Korruption der klinischen Forschung durch Pharmaindustrie
25. Horton R. Offline: What is medicine's 5 sigma? Lancet 2015;385(9976):1380. https://doi.org/10.1016/S0140-6736(15)60696-1
Richard Horton über die Unzuverlässigkeit der medizinischen Literatur
26. Simes RJ. Prospective meta-analysis of cholesterol-lowering studies: the Prospective Pravastatin Pooling (PPP) Project and the Cholesterol Treatment Trialists (CTT) Collaboration. Am J Cardiol 1995;76(9):122C-126C.
Methodische Analyse der Run-in-Phasen in Cholesterinstudien
27. Associated Press. Merck agrees to pay $4.85 billion in Vioxx settlement. USA Today 2007 Nov 9. https://usatoday30.usatoday.com/money/industries/health/drugs/2007-11-09-merck-vioxx_N.htm
Offizielle Berichterstattung über die 4,85 Milliarden Dollar Vioxx-Vergleichszahlung
KI-Disclaimer im Spoiler
Für die Erstellung dieses Beitrags habe ich Claude Sonnet 4 (Anthropic) als technisches Werkzeug eingesetzt, um zu recherchieren, zu strukturieren, zu formatieren und die wissenschaftliche Literatur zu analysieren. Dabei habe ich die Inhalte inhaltlich vollständig selbst bestimmt und gesteuert. Die KI diente ausschließlich als Assistenz zur Umsetzung meiner konkreten Vorgaben. Die KI unterstützte lediglich bei der technischen Umsetzung meiner Anweisungen. Somit handelt es sich bei dem vorliegenden Text um eine eigenständige Leistung, bei der KI-Tools lediglich als Hilfsmittel zur Effizienzsteigerung genutzt wurden. Dieser Disclaimer entspricht den aktuellen Empfehlungen zur transparenten Kennzeichnung von KI-Nutzung in wissenschaftlichen und publizistischen Kontexten.